Сярна киселина - химични свойства и промишленото производство
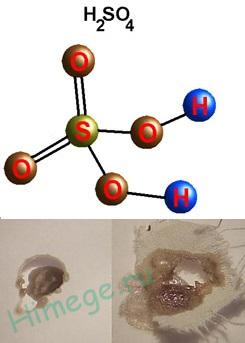
Тежката маслена течност ( "масло Витролово");
плътност 1,84 г / см3; енергонезависима, силно разтворим във вода - със силна топлина; т ° топене. = 10,3 ° С, т ° нагрява. = 296 ° С, много хигроскопична, тя е дехидратиране свойства (овъгляване хартия, дърво, захар).
Топлината на хидратация е толкова висока, че сместа да кипи, пулверизира и да предизвика изгаряния. Следователно е необходимо да се добави киселина във вода, но не и обратно, тъй като добавянето на вода към киселина вода ще бъде по-лесно киселина повърхност, където се фокусира всички освободената топлина.

Промишленото производство на сярна киселина (метод контакт):
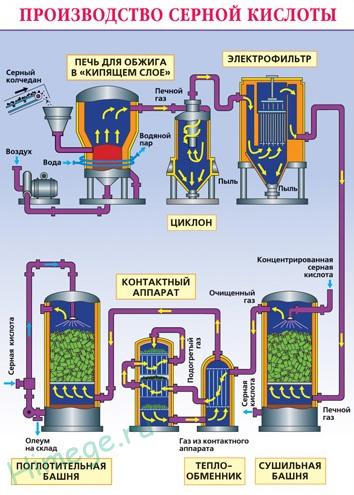
Натрошен пречистен мокро пирит (пирит) от по-горе се излива в пещта в "кипящ слой". Дъно (принцип противоток) преминаване на въздух, обогатен с кислород.
От пещта излиза газ пещ, чийто състав е: SO2. O2. водна пара (пирит е мокра) и фини частици угарки (железен оксид). Газът пречиства на частици от твърди примеси (в циклона и електростатични) и водна пара (в кула за сушене).
Устройството за контакт на серен диоксид се окислява като се използва катализатор V 2О 5 (ванадиев пентоксид), за да се увеличи скоростта на реакцията. Окислението на един окис на другата е обратимо. Следователно, оптималните условия се избират директно взаимодействие поток - високо налягане (от протича директно взаимодействие с намаляване на общия обем) и температурата не е над 500 ° С (тъй като реакцията е екзотермична).
В абсорбционната кула възниква абсорбция на серен оксид (VI) с концентрирана сярна киселина.
абсорбция на вода не се използва, тъй като серен оксид се разтваря във вода, за да се освободи големи количества топлина, така че образува сярна киселина кипи и се превръща в пара. За да се избегне образуване на мъгла на сярна киселина, използвана -ing 98% концентрирана сярна киселина. Серен оксид е много разтворим във форма киселина олеум: H 2SO 4 · nSO3
Химичните свойства на сярна киселина:
H 2SO 4 - силно двуосновен киселина, един от най-силните минерални киселини, поради H висока полярност връзка - О лесно разкъсан.
1) воден разтвор на сярна киселина се разлага. образуване на водородни йони и киселинен остатък:
H 2SO 4 = H + + HSO4 -;
HSO4 - = + Н + SO4 2-.
Общото уравнение:
H 2SO 4 = 2Н + + SO4 2-.
2) взаимодействие на сярна киселина с метали:
Разредена сярна киселина се разтваря само метали, стоящи в електрохимичната серия от ляво на водород:
Zn 0 + Н2 1 SO4 (разредена) → Zn 2 SO4 + Н2
5) Реакцията на обмен на соли:
BaCl2 + H 2SO 4 → BaSO 4 ↓ + 2HCl
Образуването на бяло BaSO 4 утайка (неразтворимата в киселина), използвани за откриване на сярна киселина и разтворими сулфати (качествен реакционни за сулфат йон).
Специалните свойства на концентрирана H 2SO 4:
1) концентрирана сярна киселина е силен окислител; чрез реакция с метали (с изключение Au, Pt), за да се възстанови S 4 O2. S 0 или Н2 S -2 зависимост от метал активност. Без отопление не реагира с Fe, Al, Cr - пасивация. При взаимодействие с метали с променлива валентност Последният се окислява до по-високи окислителни състояния. отколкото е случаят с разреден разтвор на киселина: Fe 0 → Fe 3+. 0 Cr → Cr 3+. 0 Mn 4+ → Mn, Sn → Sn 4+ 0
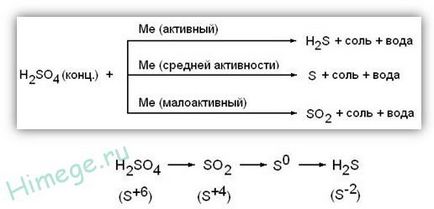
Метални умерено активен
2) концентрирана сярна киселина се окислява някои неметали са склонни да се увеличи окисляването се възстановява DOS + 4O2:
3) окисление на комплексни вещества:
Сярната киселина се окислява НВг и HI на свободни халогени:
KBr 2 + 2Н2 SO4 = К2 SO4 + SO2 + Br2 + 2Н2 О
2 KI + 2Н2 SO4 = К2 SO4 + SO2 + I2 + 2Н2 О
Концентрирана сярна киселина не може да се окисли хлорид йон на хлор, който позволява производството на солна киселина чрез взаимодействие обмен:
NaCl + H 2SO 4 (конц.) HCl + = NaNSO4
Сярна киселина отнема химически свързаната вода от органични съединения, съдържащи хидроксилни групи. Дехидратацията на етанол в присъствието на концентрирана сярна киселина води до получаването на етилен:
С2 Н5 OH = С2 H4 + Н2 О.
. Овъгляване на захар, целулоза, нишесте и други въглехидрати в контакт със сярна киселина се дължи на тяхната дехидратация:
С6 Н12 О6 + 12H2 SO4 = 18H2 О + 12SO2 ↑ + 6CO2 ↑.
