Как да се изчисли атомната маса
Атомна тегло е сумата от масите на протони, неутрони и електрони, които се състои от даден атом или молекула. [1] В сравнение с протони и неутрони, електрони маса е много малка, поради което не се разглеждат в изчисленията. [2] Въпреки че правилно от формална гледна точка, този термин често се използва за обозначаване на средната атомна маса на всички изотопи на един елемент. В действителност, това е относителната атомната маса, наречена също атомно тегло на елемент. [3] атомно тегло - средната атомна маса на всички изотопи на един елемент се среща в природата. Химиците трябва да се прави разлика между тези два вида атомна маса при извършване на работата - грешна стойност атомната маса може, например, да доведе до неправилно резултат на добива на реакцията.
стъпки Редактиране
Метод 1 от 3:
Намирането на атомната маса на периодичната таблица на елементите Редактиране


- атомна маса единица характеризира масата на един мол на елемента в грамове. Тази стойност е много полезно в практически изчисления, тъй като тя може да помогне за лесно прехвърляне на предварително определено количество от масата на атома или молекули на веществото в молове, и обратно.


- Имайте предвид, че всички относителни атомни маси, изброени в периодичната таблица, за всяка позиция са средни стойности. В химичните елементи имат различни изотопи - химически варианти с различни маси поради допълнителните или липсващи неутроните в атомното ядро. [5] Следователно, относителните атомните маси, изброени в периодичната таблица могат да се използват като средната стойност за атомите на специфичен елемент, но не масата на атома на елемента.
- Относителната атомната маса, съдържаща се в периодичната таблица, използвана за изчисляване на моларните маси на атоми и молекули. Атомна маса, изразена в Аму (Тъй като в Периодичната таблица) е по същество безразмерна. Въпреки това, просто чрез умножаване на атомно тегло от 1 г / мол, ние получаваме полезна характеристика елемент - маса (в грамове) на мол атоми на този елемент.


- Тъй като средната атомна маса е средна стойност за няколко изотопи, стойността, посочена в периодичната таблица не е точната стойност на всички единични атомни масови атома.
- Атомната маса на отделните атоми се изчислява като се вземе предвид точния брой протони и неутрони в един атом.
Метод 2 на 3:
Изчисляване на атомната маса на един атом Edit
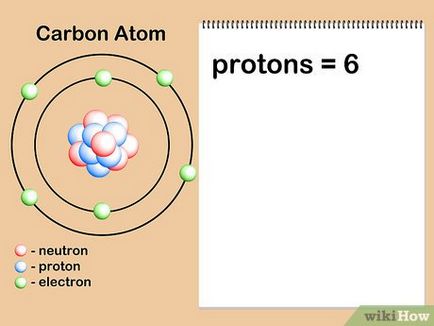

- Да предположим, че ние се интересуваме въглероден атом. въглеродните атоми са винаги шест протони, така че ние знаем, че неговата атомен номер е 6. В допълнение, ние виждаме, че има номер "6" в периодичната таблица, в горната част на клетката с въглероден (С), което показва, че атомното въглероден брой е равен на шест.
- Имайте предвид, че атомният номер на елемента не е свързан по уникален начин за нейната относителна атомна маса в периодичната система. Макар че, особено за продукти в горната част на таблицата, тя може да изглежда, че атомната маса на елемента на два пъти му атомен номер, той никога няма да се изчислява, като се умножи атомен номер по две.
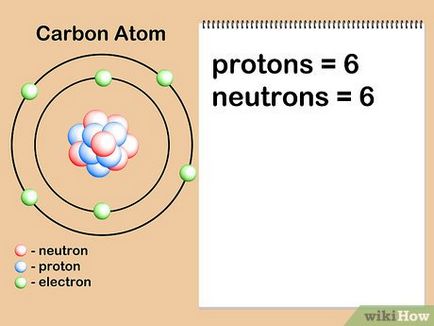

- Броят на неутроните може да се определи чрез маркиране елемент изотоп. Например, въглерод-14 е радиоактивен изотоп въглерод-12, се срещат в природата. Често изотопа номер е показан като суперскрипт номера, застанал пред елемент символ 14 С. Количеството на неутроните се получава чрез изваждане на броя на протоните в изотоп стая: 14 - 6 = 8 неутрони.
- Да приемем, че се интересуват въглероден атом е шест неутрони (12 С). Това е най-честата изотоп на въглерод, с приблизително 99% от всички атоми на даден елемент. [7] Въпреки това, около 1% от въглеродни атоми имат 7 неутрони (13 С). Други видове въглеродни атоми са по-голямо от 7 или по-малко от 6 неутрони и съществуват в много малки количества.
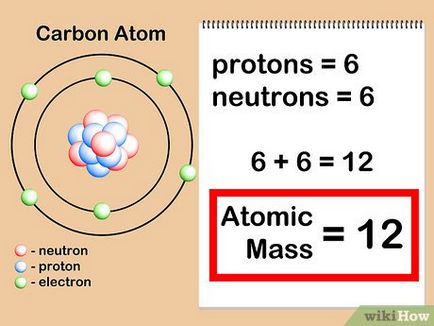

- Нашата въглероден атом има 6 протони + 6 неутрони = 12. По този начин, атомно тегло на въглерода е равен на 12. Ако това е изотоп "въглерод-13", тогава ние ще знаем, че той разполага с 6 протони + 7 = неутронна ядрените маса 13.
- В действителност, атомната маса на въглерод-13 е 13.003355 [8]. и тази стойност е по-точен, защото той беше определен чрез експериментиране.
- Атомна маса е много близо до броя на изотопа. За улеснение на изчисляване на броя на изотопа често се задава равна на атомната маса. Експериментално определеното стойност на атомната маса на изотопа леко да надвишава броя на много малък принос от електроните.
Как да се определи степента на окисление


Как да се намери броя на протони, неутрони и електрони

Как да се изчисли концентрацията на разтвора

Как да си направим сух лед


Как да използвате периодичната таблица


Как да съхранявате сух лед

Как да подкиселява почвата


Как да се изчисли моларност на разтвора


Както неутрализират амоняк


Как да се мине изпита по химия