Периодичен закон и т.н.


Една група от елементи е вертикална последователност на химическите елементи в периодичната система. Всяка група има две подгрупи: основните и страна. Елементите на първите три периода се отнасят само за основните подгрупи. Сред основните подгрупи са също елементи на дълги периоди от време (от четвъртата), които са разположени на една и съща страна на клетката, както и елементи от първите три периода. Например, химичен елемент калиев на (К) за четвъртия период на първата група принадлежи към основната подгрупа, и мед (Си), разположен в същия период и съща група - напречен.
Да разгледаме две атом: водороден атом и литиев атом (Li). Двете атоми са в същата група (I) и всеки има един електрон във външен електронен слой. Разликата е, че външната електрона на водородния атом е на първия електронен слой, като литиево - секунда. Очевидно е, че размерът на литиеви атоми от водородни атоми (фиг. 3.3).
Фиг. 3.3. Сравнение на размерите на водородните атоми на литиев и разположени в една и съща група
"Свойствата на елементите, и следователно те образуват прости и сложни обекти (вещества), са в зависимост от периодичната атомно тегло."
"Свойства на химичните елементи (т.е., свойствата и форма на съединенията образувани от тях) са в периодично зареждане в зависимост от ядрото на атома на химическите елементи."
Физическият смисъл на химически периодичността
Периодични промени в свойствата на химичните елементи, причинени от повторение на най-добрата конфигурация на външната електронен ниво на енергията (валентност електрон) на техните атоми с увеличения ядрени заряда.
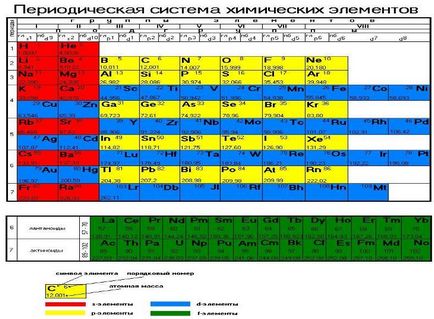
Графично представяне на периодичния закон е периодичната таблица. Той съдържа периоди 7 и 8 групи.
Период - хоризонтални редове от елементи с един и същи максималната стойност на главницата квантовата броя на валентните електрони.
период брой представлява броя на енергийните нива на атомите на елемент.
Периодите могат да се състоят от две (първи), 8 (втори и трети), 18 (четвърти и пети) или 32 (шести) елементи, в зависимост от броя на електроните в външни нива на енергия. Последно, на седмия период е непълна.
Всички периоди (с изключение на първия), започващи на алкален метал (и - елемент) и завършва благороден газ (NS 2 NP 6).
Метални свойства се разглеждат като елементи способност атома лесно дари електрони, и неметални - закрепване на електрони от атомите на желанието да придобие стабилна конфигурация с пълни поднива. Външно пълнене и - показва подслой метални свойства атом и образува външен р - подниво - на метални свойства. Увеличаването на броя на електрони на р - подниво (1 до 5) подобрява свойствата на неметални атоми. Атомите с напълно оформен енергично стабилна конфигурация външни електронни слой (НЧ 2 NP 6) е химически инертни.
В големи периоди от преход от свойствата на активното метал за благородния газ стават по-гладко, отколкото в малките периоди, тъй като Това е образуването на вътрешния (п - 1) г - при запазване на външните подслой NS 2 - слой. Големи периоди се състоят от странни и дори редове.
В елементи на четните редове във външния слой 2 НЧ - електрони, следователно преобладават метални свойства и тяхната затихване с увеличаване на ядрен заряд е ниска; в нечетните редове формира NP - подниво, което обяснява значителното поевтиняване на металните свойства.
Групи - вертикални колони от елементи с еднакъв брой валентните електрони равни на броя на група. Разграничаване между основните и вторичните подгрупи.
Root подгрупа елементи се състоят от малки и големи периоди валентност електрони, които са разположени на външните NS - и NP - поднива.
Странични подгрупи се състоят от елементи, само големи периоди от време. Техните валентните електрони са на външните NS - вътрешен подслой и (п - 1) г - подслой (или (п - 2) е - подниво).
В зависимост от това, което подслой (а -, р -, г - и е -) напълнени валентните електрони на елементите на периодичната система са разпределени в: S - елементи (елементи на основната група I и II групи), р - елементи (елементи на основната група III - VII групи), г - елементи (странични елементи на подгрупи), е - елементи (лантаниди, актиниди).
Основните подгрупи от горе до долу метални свойства са засилени и неметални отслаби. Елементи на основните и странични групи са много различни в техните свойства.
номер група показва по-висока валентност елемент (освен О. Е. подгрупа елементи мед и осмата групи).
Елементи общи за основните и подгрупи с формула са по-високи окиси (и техните хидрати). При по-високи оксиди и техните хидрати елементи I - III група (с изключение на бор) са контролирани от основните свойства на IV с VIII - киселина.
За общи елементи основни подгрупи са съединения с формула водород. Елементите на основната група I - III групи образуват твърди вещества - хидриди (водород окисление - 1), и IV - VII групи - газообразни. Водородни съединения с подгрупи IV елементи основна група (EN 4) - неутрален, V група (EN 3) - база, VI и VII групи (H 2 ОЕ и NE) - киселина.
От позицията на елементи в зависимите периодичната система свойства на атом свързан към електронния му конфигурация: атомната радиус - от ляво на дясно намалява през периода, и в подгрупа надолу увеличава; йонизационна енергия - увеличенията период и спадове в подгрупата; Електроотрицателност - увеличава периода и намалява в подгрупата.
Позицията на елемента в периодичната система може да предскаже неговите основни свойства като средната стойност на всички свои съседи:
характеризиране химични елементи, въз основа на периодичната таблица с атомни номера 21 и 34.
За да характеризира химичните елементи от периодичната система на Менделеев следва да се считат:
Позицията на периодичната таблица (пореден номер; период ред група, подгрупа; атомна маса).
Атомна структура (основен заряд; ядро състав - броя на протоните р 1 1 0 1 N неутрони и електрони # 275 ;; броят на енергийните нива и поднива; напиши формулата на конфигурацията на електрони; квантовата клетка; броя и естеството на електроните валентните определи вида на елемента).
Формулите и химическата природа на съединения (по-висока оксид и хидроксид; водородни съединения).
Сравнете със съседите (за периода, в зависимост от групата).
Номер елемент Z = 21 представлява: зареждащия елемент атомното ядро (Sc): 65 21 Sc - +21; броя на протоните р 1 1. 21 Sc - 21 1 т 1; броя на електроните # 275;: 21 Sc - 21 # 275 ;; броя на неутроните п 1 0 = A R - Z = 65 - 21 = 44 - 1 0 44 N
Формула структура на атома
Скандий е период IV; период броят показва броя на енергийните нива - 4.
Скандий се намира в подгрупите. Следователно, неговите валентните електрони се съхраняват при 4 S - и 3 г - поднива.
E формула скандий
Скандий - г - елемент. Електронната структурата на атома завършва S - електрони, така че елементът ще проявяват метални свойства.
Формула висока оксид - Sc 2О 3. хидроксид - Sc (ОН) 3 имат слаби основни свойства. Съединения с водород не образуват.
Б) номер на последователност 34 има селен Se. IV елемент е в периода, има средство 4 в нива атом енергия. Той се намира в основната подгрупата Група VI; неговите валентните електрони са разпределени в 4 и 4 и п - поднива.
E-селен формула:
34 Se 1s 2s 2 2 2 2p 6 3s 3P 6 3d 10 4S 2 4P 4
Външният слой под формата на квантовата клетки е както следва:
селенов атом има шест валентните електрони; толкова по-висока валентност равна на 6, което отговаря на броя на група.
Селен - р - елемент следователно ще бъде неметални свойства.
3. висше оксид SEO му хидроксид Н2 SEO 4 и газообразен водород съединение Н2 Se има киселинен характер.
Периодичният закон и периодичната система на химичните елементи DI Менделеев. Радиусите на атомите и техните периодични изменения в системата на химическите елементи. Законите на химичните свойства на елементи и техните връзки с периоди и групи.
Периодично право е открит D. I. Mendeleevym през 1869 г. Тук е модерна форма на неговите "свойства на химичните елементи и техните съединения са в периодична зависимост от заряда на ядрата на атомите." Това означава, че ако поставите химическите елементи във възходящ ред на ядрото, техните свойства ще бъдат първите постепенно да се променя, а след това на няколко елементи на тези промени ще бъдат повторени.
Причината за тези промени е електронната структура на атома. Atom подредени така, че електроните в него не са подредени произволно но в слоя. В първия слой само два електронни следователно химични свойства чрез повтаряща се елемент 2 (фиг. 3.1.). Във втория електронен слой могат да се настанят 8 електрони, така химични свойства се повтарят след 8 елементи. Освен това връзката между максималния брой на електрони на нивото на повторяемост и химични свойства на елементите, става по-сложно, но свойствата на химичните елементи също се повтаря.